Zytotoxizitätstests an Medizinprodukten
Zytotoxizitätstests sind für die Bewertung der Sauberkeit und Biokompatibilität von Medizinprodukten essentiell. Diese Tests messen gezielt die toxische Wirkung, die ein Material auf Zellstrukturen haben kann und sind Bestandteil der Norm DIN EN ISO 10993-5. Ziel ist es, sicherzustellen, dass die Produkte keine schädigende Wirkung auf Zellen haben und somit sicher in der Anwendung sind. Wesentlich für eine zuverlässige Bewertung der Zytotoxizität von Medizinprodukten sind die Extraktions- und Inkubationszeiten, die je nach Produkt unterschiedlich sein können. Auch die Reproduzierbarkeit der Prüfungen, insbesondere bei Wiederholungsprüfungen oder Prüfungen im Rahmen des Monitorings, ist von entscheidender Bedeutung.
Prüfverfahren
Das Prüfverfahren für Zytotoxizitätstests umfasst mehrere Schritte, die sicherstellen, dass die getesteten Produkte keine schädlichen Auswirkungen auf Zellen haben:
- Probenvorbereitung: Medizinprodukte werden in einem geeigneten Medium für 4 bis 72 Stunden extrahiert, um potenziell toxische Substanzen zu lösen.
- Zellkultur: Geeignete Zelllinien wie Fibroblasten oder Epithelzellen werden verwendet, da sie eine hohe Sensitivität gegenüber toxischen Substanzen aufweisen.
- Inkubation: Die Zellen werden mit dem Extrakt des Produkts für eine festgelegte Zeitspanne (24 bis 72 Stunden) inkubiert.
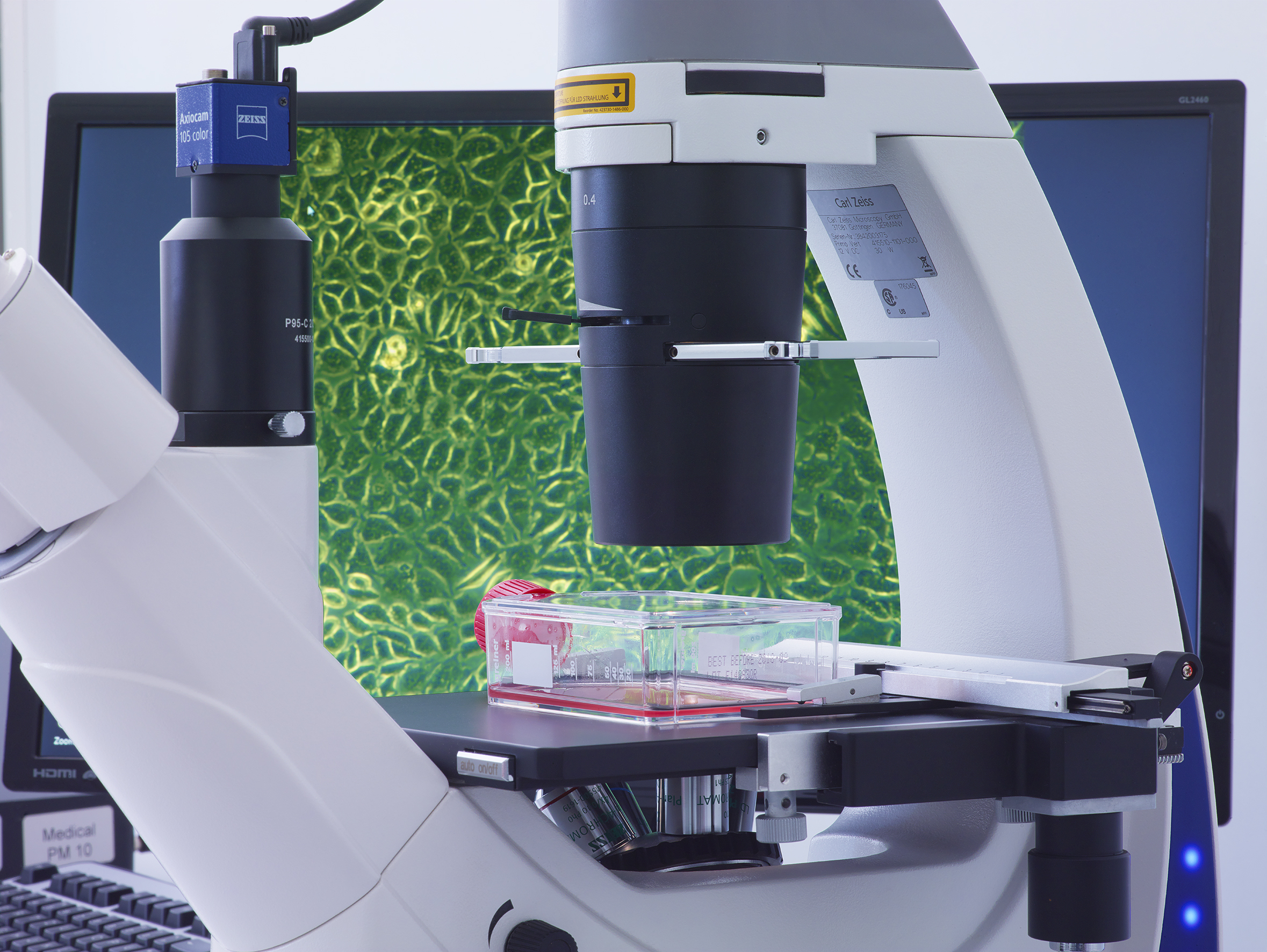
- Beobachtung: Nach der Inkubation werden die Zellen unter dem Mikroskop auf morphologische Veränderungen und Wachstumsverhalten untersucht.
- Auswertung: Ein quantitatives Ergebnis wir ermittelt. Dies kann mittels verschiedener Methoden geschehen, je nach Fragestellung und regulatorischer Anforderung.
Zelllinien
Zelllinien sind kultivierte Zellen, die in der Forschung und in Tests wie Zytotoxizitätstests weit verbreitet sind. Sie bieten eine konsistente und reproduzierbare Plattform für die Bewertung der Zellreaktionen auf verschiedene Substanzen. Zu den häufig verwendeten Zelllinien gehören:
- Fibroblasten: Diese Zellen sind besonders sensitiv gegenüber toxischen Substanzen und werden häufig in Zytotoxizitätstests verwendet und kommen auch bei CleanControlling zum Einsatz.
- Epithelzellen: Diese Zellen sind ebenfalls weit verbreitet und eignen sich gut für Tests, die die Interaktion von Materialien mit Zelloberflächen bewerten.
Spezifische Anforderungen für Zelllinien
- Authentizität: Die Zelllinien müssen verifiziert und frei von Kontaminationen sein.
- Passagenzahl: Die Zellen sollten sich in einer niedrigen Passagenzahl befinden, um genetische Drift zu vermeiden.
- Kulturbedingungen: Die Kulturbedingungen müssen standardisiert sein, einschließlich Temperatur, CO₂-Konzentration und Nährmedium.
Extraktions- und Inkubationszeiten
Extraktions- und Inkubationszeiten sind entscheidende Parameter bei Zytotoxizitätstests. Sie variieren je nach Art des Medizinprodukts. Die folgenden Optionen können als erste Richtlinie verwendet werden, die endgültige Entscheidung muss jedoch vom Hersteller auf der Grundlage einer Risikobewertung getroffen werden:
Extraktionszeit:
- Unkritische Produkte: 24 Stunden (bei Kurzzeitanwendung mit Begründung des Herstellers auch 4 Stunden möglich)
- Implantate: 72 Stunden
Inkubationszeit:
- Unkritische Produkte: 24 Stunden
- Standard-Instrumentarium: 48 Stunden
- Implantate: 72 Stunden
Auswertemethoden
Es gibt verschiedene Auswertemethoden für Zytotoxizitätstests, die in der Norm DIN EN ISO 10993-5 beschrieben sind. Diese Methoden sind Vorschläge und nicht bindend. Zu den gängigen Methoden gehören:
- MTT-Test: Misst die Zellviabilität durch die Reduktion von MTT zu Formazan.
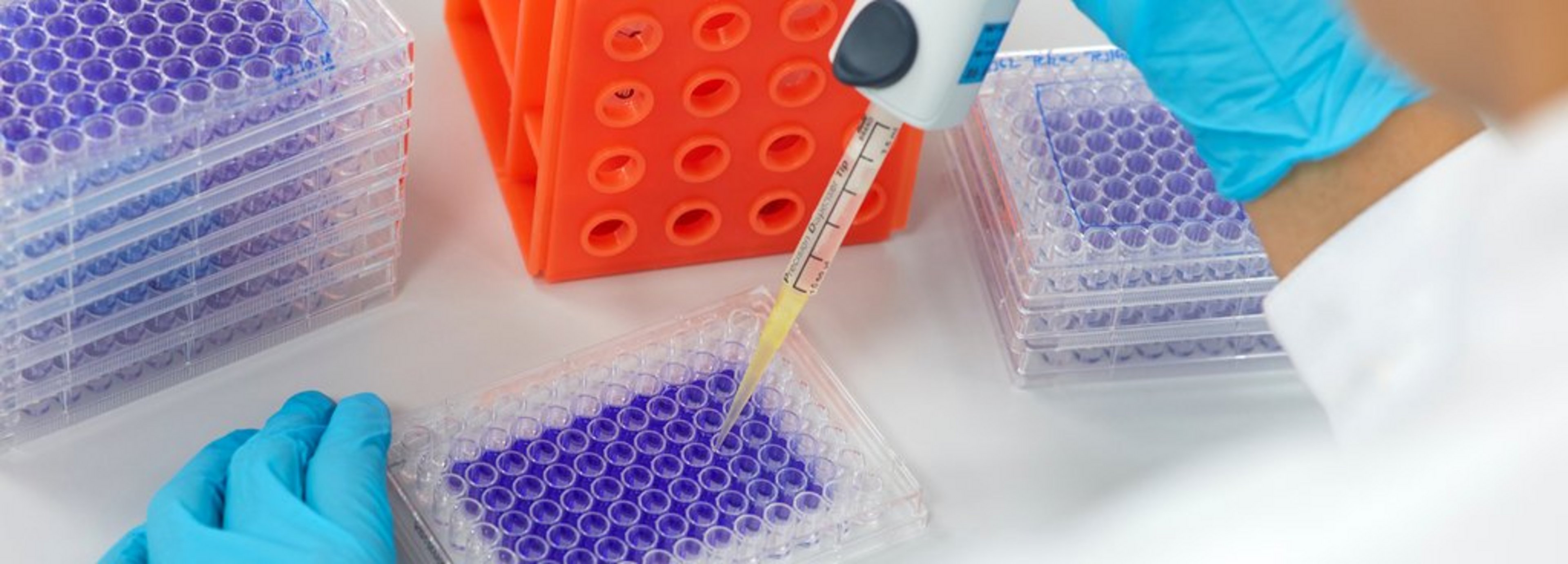
- Kristall-Violett-Färbung: Diese Methode wird zur quantitativen Bewertung der Zellviabilität verwendet.
Vergleich der Auswertemethoden
MTT-Test:
- Vorteile: Hohe Sensitivität, weit verbreitet, quantitativ.
- Nachteile: Kann durch bestimmte Substanzen beeinflusst werden, die die Reduktion von MTT stören.
Kristall-Violett-Färbung:
- Vorteile: Einfach durchzuführen, quantitativ, zuverlässig.
- Nachteile: Kann durch Zellüberlagerung beeinflusst werden, erfordert sorgfältige Durchführung.
Kristallviolettfärbung
Die von CleanControlling bevorzugte Analysemethode ist die Kristallviolettfärbung, die bei CleanControlling seit Jahren als Standard eingesetzt wird und auch akkreditiert ist. Diese Methode ist auch von der FDA anerkannt.
Verfahren der Kristall-Violett-Färbung
- Fixierung: Nach der Inkubation werden die Zellen fixiert, um ihre Struktur zu erhalten.
- Färbung: Die fixierten Zellen werden mit Kristallviolett gefärbt, einem Farbstoff, der sich an die DNA der Zellen bindet.
- Waschen: Überschüssiger Farbstoff wird abgewaschen, um nur die gefärbten Zellen zu behalten.
- Auswertung: Der gebundene Farbstoff wird wieder in Lösung gebracht, somit entsteht eine farbige Flüssigkeit, deren Intensität, mit der Anzahl der vorhandenen Zellen korreliert.
Empfehlungen
Um die Vergleichbarkeit zu vorangegangenen Analysen zu gewährleisten, empfehlen wir, die Extraktions- und Inkubationszeiten grundsätzlich beizubehalten. Diese sind in den Abschlussberichten aufgeführt. Neue Parameter sind jedoch ebenfalls möglich. Diese für den Test wichtigen Parameter können im TEST ITEM CHARACTERISATION SHEET durch den Auftraggeber vorgegeben werden und stellen dadurch die Basis für die nachfolgende Prüfplanung dar.
Generelle Empfehlung
Für Implantate:
- Extraktionszeit: 72 Stunden
- Inkubationszeit: 72 Stunden
Für andere Produkte außer Implantaten:
- Extraktionszeit: 24 Stunden
- Inkubationszeit: 48 Stunden
Fazit
Für eine zuverlässige Bewertung der Zytotoxizität von Medizinprodukten ist die Anwendung bewährter Auswertungsmethoden unerlässlich. Wesentlich für eine zuverlässige Bewertung der Zytotoxizität von Medizinprodukten sind die Extraktions- und Inkubationszeiten, die je nach Produkt unterschiedlich sein können. Für die Reproduzierbarkeit der Prüfungen, insbesondere bei Wiederholungsprüfungen oder Prüfungen im Rahmen des Monitorings, sind gleichbleibende Extraktions- und Inkubationszeiten von entscheidender Bedeutung. Diese Maßnahmen tragen dazu bei, die Sicherheit und Biokompatibilität der Produkte zu gewährleisten.
Newsletter Anmeldung